Plutonium
Le plutonium est un métal lourd très dense — approximativement 1,74 fois plus lourd que le plomb — radioactif et toxique, de numéro atomique 94, découvert aux États-Unis par Glenn T.
Définitions :
- Élément chimique de numéro atomique 94 et de symbole Pu; Métal pur de cet élément (source : fr.wiktionary)
- Élément de numéro atomique 94 dont aucun isotope n'existe dans la nature. Le plutonium 239, isotope fissile, est produit dans les... (source : francetech)
- élément radioactif combustible issu de la fission de l'uranium. (source : edf)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Général | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom, Symbole, Numéro | Plutonium, Pu, 94 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Série chimique | Actinides | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe, Période, Bloc | L/A, 7, f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 19 816 kg/m3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | blanc métallique argenté | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 244,06 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 175 (?) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | ? pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | ? pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Rn] 5f6 7s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d'énergie | 2,8,18,32,24,8,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État (s) d'oxydation | 6,5,4,3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | amphotère | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Structure cristalline | monoclinique | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Température de fusion | 912,5 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Température de vaporisation | 3503 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 2,84 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 344 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 12,29×10-6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de la vapeur | 1 Pa (à 1483°C) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vélocité du son | 2260 m/s à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 1,28 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 35,5 J/ (kg·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 685×106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 6,74 W/ (m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1e potentiel d'ionisation | 584,7 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2e potentiel d'ionisation | {{{potentiel_ionisation2}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e potentiel d'ionisation | {{{potentiel_ionisation3}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4e potentiel d'ionisation | {{{potentiel_ionisation4}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e potentiel d'ionisation | {{{potentiel_ionisation5}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6e potentiel d'ionisation | {{{potentiel_ionisation6}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7e potentiel d'ionisation | {{{potentiel_ionisation7}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8e potentiel d'ionisation | {{{potentiel_ionisation8}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9e potentiel d'ionisation | {{{potentiel_ionisation9}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10e potentiel d'ionisation | {{{potentiel_ionisation10}}} kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Le plutonium est un métal lourd très dense — approximativement 1,74 fois plus lourd que le plomb — radioactif et toxique, de numéro atomique 94, découvert aux États-Unis par Glenn T. Seaborg, Edwin M. McMillan, J. W. Kennedy et A. C. Wahl en 1940. De même que l'uranium 235, c'est une matière fissible, qui est utilisée pour son isotope 239 dans la fabrication d'armes nucléaires et la production d'énergie dans certaines centrales nucléaires. Il sert aussi à l'élaboration de générateurs thermoélectriques à radioisotope.
Origine
Le plutonium est un élément chimique artificiel quasi exclusivement produit de 1940 à nos jours. C'est le deuxième des transuraniens a avoir été découvert. L'isotope 238Pu fut produit en 1940 en bombardant une cible d'uranium par du deutérium au cyclotron de Berkeley. [1] Durant le Projet Manhattan, le plutonium 239 avait le nom de code 49, le'4'étant le dernier chiffre de 94 (le numéro atomique) et le'9', le dernier chiffre de 239 (l'isotope utilisé pour la bombe, Pu-239) [2].
Il est produit dans le cœur des réacteurs nucléaires par la transformation, sous l'effet du flux de neutrons, d'une partie de l'uranium qui compose le combustible nucléaire. En première approximation, un réacteur produit typiquement 0.8 atome de Pu239 pour chaque fission de U235, soit un gramme de plutonium par jour et par MW de puissance thermique (les réacteurs à eau légère produisant moins que les graphite-gaz). Ainsi, en France, les réacteurs nucléaires produisent annuellement environ 11 tonnes de plutonium[3].
Le plutonium est normalement absent de la biosphère, mais il a existé (et existe encore en quantités infimes) dans des structures géologiques spécifiques où de l'uranium a été naturellement concentré par des processus géologiques ou géobiologiques (bioconcentration en filons par des bactéries) il y a environ 2 milliards d'années, pour atteindre une criticité suffisante pour engendrer une réaction nucléaire naturelle. C'est le cas sur le site d'Oklo. On en trouve aussi des traces dans les minerais d'uranium naturel (de même que du neptunium), où il résulte de l'irradiation de l'uranium par les neutrons présents.
Description
Le plutonium est un métal gris, assez mou, très lourd (densité : 19,84), solide à température ambiante mais à point de fusion assez bas (640°C).
Il est synthétisé lors des explosions nucléaires (en 1952, l'explosion de la bombe thermonucléaire américaine la plus puissante a ainsi produit deux radioéléments dans ce cas encore inconnus ; le plutonium 244 (244Pu) et le plutonium-246 (246Pu).
Le plutonium est aussi un déchet ou sous-produit de fonctionnement de centrales nucléaires civiles, avec divers actinides.
Il est aussi volontairement produit par capture neutronique de l'uranium dans les réacteurs nucléaires.
Par exemple, l'isotope 239 est formé en trois étapes :
- capture neutronique de l'uranium 238 pour former de l'uranium 239 ;
- décroissance β- de l'uranium 239 (demi-vie : 23 minutes) en neptunium 239 ;
- décroissance β- du neptunium 239 (demi-vie : 2,3 jours) en plutonium 239.
Les isotopes les plus lourds du plutonium sont majoritairement formés par capture neutronique du plutonium 239.
Le plutonium est un métal argenté très radioactif (selon la composition isotopique, les isotopes 238 et 241 étant de très loin les plus radioactifs : voir tableau ci-contre), et très radiotoxique (un milligramme de plutonium peut suffire à induire un cancer). Il réagit avec l'oxygène, la vapeur d'eau et les acides. Il ne réagit pas avec les bases.
Sa période de demi-vie est de 24 000 ans pour l'isotope 239. Il y a 15 isotopes connus. Les isotopes les plus produits en réacteurs sont les isotopes 238,239,240,241,242. Tous sont radioactifs. Les isotopes de numéro atomique impair (239 et 241) sont fissiles en spectre thermique (réacteurs aujourd'hui en production).
Statut juridique
Le plutonium répond aux définitions admises de «polluant».
Lorsqu'il est produit dans les réacteurs civils ; est reconnu comme déchet par certains pays et comme matière valorisable par d'autres (dont la France).
En effet, le combustible usé déchargé des réacteurs peut être retraité afin d'en isoler le plutonium, qui est dans ce cas mélangé avec de l'uranium appauvri (issu de l'étape initiale d'enrichissement) pour former du combustible MOX. En faibles quantités, le plutonium est utilisé dans les générateurs thermoélectriques à radioisotope.
Le plutonium est aussi produit à des fins militaires dans des installations dédiées ou dans des réacteurs électrogènes selon les pays. Il est dans ce cas utilisé pour fabriquer des armes nucléaires. Il faut environ 5 kg de plutonium pour obtenir une bombe nucléaire. En tant qu'élément utile à la fabrication d'arme de destruction massive, il est suivi par divers textes et conventions mondiales.
Plutonium 239 et isotopes supérieurs
Production
L'irradiation de l'uranium 238 dans les réacteurs nucléaires génère du plutonium 239 par capture de neutron. Dans un premier temps, un atome d'U-238 capture un neutron et se transforme transitoirement en U-239. Cette réaction de capture est plus facile avec des neutrons rapides qu'avec des neutrons thermiques, mais est présente dans les deux cas.
L'U-239 formé est fortement instable. Il se transforme rapidement (avec une demi-vie de 23,5 minutes) en neptunium par radioactivité β- :
Le Np-239 est aussi instable, et subit à son tour une décroissance β- (avec une demi-vie de 2,36 jours) qui le transforme en plutonium 239 assez stable (demi-vie de 24 000 ans).
Le Pu-239 est fissible, et contribue à la réaction en chaîne du réacteur ; mais il peut aussi capturer un neutron sans subir de fission. Lorsque le combustible subit des périodes d'irradiation de plus en plus longues, les isotopes supérieurs s'accumulent à cause de l'absorption de neutrons par le plutonium 239 et ses produits. Il se forme ainsi des isotopes 240Pu, 241Pu, 242Pu, jusqu'au 243Pu instable qui se désintègre en américium 243.
- L'isotope intéressant par son caractère fissible est le Pu-239, assez stable (24 000 ans).
- L'isotope suivant, le Pu-240, est simplement fertile, et présente une radioactivité "seulement" quatre fois plus élevée (6500 ans).
- Le Pu-241 est aussi fissible, mais fortement radioactif (demi-vie de 14 ans).
En outre il se désintègre en produisant de l'américium 241 neutrophage, ce qui diminué l'efficacité des dispositifs nucléaires militaires.
Le rythme de production d'un isotope dépend de la disponibilité de son précurseur, qui doit avoir eu le temps de s'accumuler.
Dans un combustible neuf, le Pu-239 se forme par conséquent linéairement selon le temps, la proportion de Pu-240 augmente suivant une loi au carré du temps (en t2), celle de Pu-241 suivant une loi au cube du temps (en t3), et ainsi de suite.
Ainsi, lorsque on utilise un réacteur spécifique pour la fabrication du «plutonium militaire», le combustible utilisé pour la production du plutonium autant que les cibles et la couverture s'il y en a, sont extraits après un bref séjour (quelques semaines) dans le réacteur afin d'avoir l'assurance que le plutonium 239 est aussi pur que possible.
En revanche, pour des usages civils, une brève irradiation n'extrait pas toute l'énergie que le combustible peut produire. On n'enlève par conséquent le combustible des réacteurs électrogènes qu'après un séjour bien plus long (3 ou 4 ans).
Retraitement
Une fois le combustible, les cibles et la couverture enlevés du réacteur dans lequel ils ont été irradiés, ils subissent un traitement chimique, qui se nomme le retraitement des combustibles irradiés, dans une usine ou un atelier pour séparer le plutonium.
Les deux plus grandes installations mondiales recyclant le plutonium sont basées à La Hague ainsi qu'à Sellafield[4].
Plutonium 238
Dans les centrales nucléaires, du plutonium 238 est formé parallèlement au plutonium 239, par la chaîne de transformation commençant par l'uranium 235 fissible.
- L'U-235 qui capture un neutron thermique peut se stabiliser par émission d'un rayonnement γ dans 16% des cas. Il forme dans ce cas un atome d'U-236, assez stable (demi-vie de 23 million d'années).
- Une deuxième capture neutronique le transforme en U-237 (pour mémoire, des atomes d'U-238 peuvent aussi subir une réaction (n, 2n) qui les transforment en U-237 par perte d'un neutron). L'U-237 est instable avec une demi-vie de 6,75 jours, et se transforme par émission β- en Neptunium 237, assez stable (demi-vie de 2,2 millions d'années).
- Une troisième capture neutronique transforme le noyau en neptunium 238, instable de demi-vie 2,1 jours, qui se transforme en plutonium 238 par émission β-.
Le plutonium 238, d'une demi-vie de 86,41 ans, est un émetteur très puissant de rayonnement α. En raison de son activité massique alpha et gamma élevée, il est utilisé comme source de neutrons (par "réaction alpha" avec des éléments légers), comme source de chaleur et comme source d'énergie électrique (par la conversion de la chaleur en électricité). Les utilisations du Pu-238 pour produire de l'électricité sont cantonnées aux stimulateurs cardiaques ainsi qu'aux utilisations spatiales.
On prépare le plutonium 238 à partir de l'irradiation neutronique du neptunium 237, un actinide mineur récupéré au cours du retraitement ou à partir de l'irradiation de l'américium, en réacteur. Dans les deux cas, pour extraire le plutonium 238 des cibles, on les soumet à un traitement chimique, comportant une dissolution nitrique.
Il n'y a qu'environ 700 g/t de neptunium 237 dans le combustible des réacteurs à eau ordinaire irradié pendant 3 ans, et il faut l'extraire sélectivement.
Dioxyde de plutonium
Le dioxyde de plutonium (PuO2) est pour les radiochimistes la forme parfaite pour manipuler le dangereux élément. Découvert en 1940 par les chimistes américains partis sur le chemin de la bombe atomique, on le retrouve pour le recyclage des combustibles nucléaires, la confection des ogives ou le stockage des déchets radioactifs. Il s'agit d'une poudre de cristaux jaunes-verts.
Il a longtemps été reconnu comme inoxydable. Longtemps le trioxyde de plutonium (PuO3) a été recherché mais personne n'a jamais réussi à en fabriquer. Toutefois en 2000, le laboratoire de Los Alamos (Nouveau-Mexique) a montré que PuO2 peut en fait réagir simplement avec l'eau, à une température allant de 25 à 350°C, pour former un composé stable plus oxydé : la proportion entre l'oxygène et le plutonium peut aller jusqu'à 2,27. De plus, cette réaction dégage du dihydrogène, un gaz inflammable.
Ceci est problématique, car l'eau serait le principal vecteur potentiel de dissémination radioactive lors du stockage des déchets en profondeur. Une fraction du nouvel oxyde formé pourrait se dissoudre dans l'eau et se disséminer lentement aux alentours.
En France, le dioxyde de plutonium est stocké en surface, dans des boites étanches, pour être ensuite réutilisé dans des centrales ordinaires, en entrant dans la composition du combustible MOX (MiXed Oxyde).
Précautions
Contrôle des matières nucléaires
Le plutonium est une matière nucléaire dont la détention est réglementée (Article R1333-1 du code de la défense).
Radioprotection
Ce métal est normalement absent dans la nature à la surface du globe, mais il a été produit et diffusé en quantité significative et encore mesurable dans l'atmosphère et la biosphère, principalement dans les années 1945 à 1970 par les essais et tirs nucléaires (et marginalement avec aussi des retombées plus locales ou régionales lors de la catastrophe de Tchernobyl).
Tous les isotopes et composés du plutonium sont toxiques et radioactifs.
Ce qui le rend dangereux est d'une part sa forte activité spécifique, et d'autre part l'énergie de ses émissions alpha (de l'ordre de 5 MeV, à comparer au 0,02 MeV du tritium). Le plutonium est d'autant plus dangereux que sa période radioactive est courte : le Pu239 est comparativement quatre fois moins radioactif que le Pu240. Le radio isotope le plus dangereux est le Pu241, qui est extrêmement radioactif (mille fois plus que les précédents), est un émetteur béta-moins (donc plus pénétrant que les particules alpha), et présente dans sa chaîne radioactive des émetteurs gamma dur particulièrement dangereux, l'americium-241. Paradoxalement, c'est par conséquent le plutonium dit "de qualité militaire", formé principalement de Pu239, qui est le moins dangereux en termes de radiotoxicité : il est assez stable, et peut être manipulé avec des gants épais. [5]
| Isotope | Activité spécifique (Curie / g) | Activité spécifique (x10ˆ9 Bq / g) |
|---|---|---|
| Pu 238 | 17,3 | 640 |
| Pu 239 | 0,063 | 2,3 |
| Pu 240 | 0,23 | 8.5 |
| Pu 241 | 104 | 3848 |
Pour ces raisons, les installations industrielles qui opèrent sur du plutonium (typiquement, les usines de retraitement) sont des installations très lourdes en termes de radioprotection. Là où une simple boîte à gants suffit pour traiter l'uranium naturel ou enrichi en amont du cycle, le traitement du plutonium nécessite des barrières de protection épaisses (murs en béton boré, hublots épais,... ), même lorsque il n'est pas associé à des produits de fission (comme c'est le cas en début de traitement).
Toxicocinétique
Le plutonium a quelquefois été décrit comme la «substance la plus toxique connue par l'homme». C'est un émetteur de rayonnement alpha, type de rayonnement aisément arrêté par les parois fines, y compris par la peau. Cependant, s'il est inhalé ou ingéré, il irradie directement les cellules des organes qui sont en contact avec lui (ou qu'il a pénétré). Il peut dans ce cas affecter leur noyau et l'ADN et provoquer des cancers. Son activité interne est d'autant plus dangereuse qu'une part importante du plutonium absorbé par l'organisme s'y fixe durablement ; sa demi-vie biologique est estimée être de 200 ans[6]. À cause de ses caractéristiques et nombreux isotopes, il faudrait distinguer la toxicité de court, moyen et long terme, et les cas d'exposition externe et interne.
En cas d'ingestion par un individu sain, seul environ 0,05% est absorbé par le tube digestif.
Le plutonium franchit mal la barrière cutanée (si la peau est en bon état).
Par contre, une part importante du plutonium inhalé passe des poumons au sang qui le diffuse vers d'autres organes, plus ou moins vite et bien selon la taille des particules, et selon la nature et la solubilité du composé. Chez l'animal de laboratoire exposé à des taux élevés de plutonium, les tissus cibles ont été les poumons, les ganglions lymphatiques, le foie et les os (avec réduction de la durée de vie, cancers et pathologie pulmonaires).
On estime que chez l'Homme, 10% du plutonium qui a franchi la barrière intestinale ou pulmonaire quitte le corps (via l'urine, et les excréments). Le reste après passage dans le sang se fixe pour moitié dans le foie et pour moitié dans le squelette, où il demeure très longtemps et pour partie à vie (Le DŒ américain estime que la demi-vie dans l'organe est respectivement de 20 et 50 ans pour le foie et l'os, selon des modèles simplifiés ne tenant pas compte de redistributions intermédiaires (en cas de fracture et/ou de ménopause (cf. décalcification) et lors du recyclage normal de l'os, etc). Le DŒ précise que le taux accumulé dans le foie et le squelette dépend aussi de l'âge de l'individu (l'absorption dans le foie augmente avec l'âge), et qu'en fait, le plutonium se fixe d'abord sur la surface corticale et trabéculaire des os avant d'être lentement redistribué dans tout le volume minéral osseux.
Voir aussi
Liens externes
- (fr) Pu - tableau périodique des éléments (Faculté de chimie de Split)
- (fr) Fiche d'informations sur le Pu (Areva)
- (en) Les expérimentations humaines sur le plutonium aux États-Unis (Los Alamos Science, 23,1995)
- (en) Plutonium, par le "World Nuclear Association"
- (en) Toxicological Profile for Plutonium, ATSDR, U. S. Department of Health and Human Services
Références
- ↑ Plutonium production, Federation of American Scientists.
- ↑ (en) E. F. Hammel, «The taming of "49" — Big Science in little time. Recollections of Edward F. Hammel». Consulté le 24 mai 2008. Cette convention a été étendue pour tous les actinides, dans les équations décrivant la dynamique de leur population dans des réacteurs. Ainsi, l'isotope 235 de l'uranium (92) reçoit dans les équations l'indice 25 et ainsi de suite.
- ↑ Rapport Bataille 1997/1998 au Sénat.
- ↑ Sellafield, où, à l'usine de retraitement de Thorp, le 19 avril 2005, a été découverte une fuite de 200 kg de plutonium perdus avec 83 000 litres de matière radioactive dans une pièce en béton armé (conçue pour recueillir d'éventuelles pertes). Cette fuite a fait suite à une rupture de canalisation qui n'avait pas été détectée, les techniciens n'ayant pas — durant plusieurs mois — pris en compte les indicateurs d'alerte à ce sujet, qui montrait une perte de poids de la cuve signifiant une fuite. Craignant un accident de criticité, l'autorité de sûreté a provisoirement fermé l'une des deux installations jumelles.
- ↑ FAS fact sheet
- ↑ Radiological control technical training DŒ-HDBK-1122-99, U. S. Department of Energy.
Recherche sur Google Images : |
|
"Le Plutonium 239, représenté par le ..." L'image ci-contre est extraite du site www.colidre-ft.asso.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (636 x 583 - 180 ko - jpg)Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) :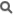 Refaire la recherche Refaire la recherche |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 13/11/2008.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.

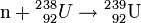
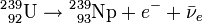

 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité